Dr. Artemis Koumoundourou aus der Arbeitsgruppe von Prof. Stefan Britsch vom Institut für Molekulare und Zelluläre Anatomie der Universität Ulm wurde für die Identifizierung eines Bcl11b/C1ql2/Nrxn3(25b+)-abhängigen Signalwegs bei der Funktionssteuerung hippocampaler Moosfaser-CA3 Synapsen mit dem Quarterly Publication Award (QPA) I/2024 der Anatomischen Gesellschaft ausgezeichnet.
Das menschliche Gehirn besteht aus Milliarden von Neuronen, die zusammenarbeiten, um die vielen Informationen zu verarbeiten, die wir aus unserer Umgebung erhalten. Diese Neuronen kommunizieren an Verbindungsstellen, den so genannten Synapsen, wo chemische Überträgerstoffe in sogenannten Vesikeln, die von einem Neuron freigesetzt werden, eine Reaktion in einem anderen Neuron auslösen. Diese synaptische Kommunikation ist entscheidend für unsere Fähigkeit zu denken, zu lernen und uns zu erinnern.
Diese Aktivität hängt jedoch von einem komplexen Zusammenspiel von Proteinen ab, deren Gleichgewicht und Position innerhalb des Neurons streng kontrolliert werden. Jede Störung dieses empfindlichen Gleichgewichts kann zu erheblichen Problemen führen, einschließlich neurologischer Entwicklungsstörungen und neuropsychiatrischer Erkrankungen wie Schizophrenie und geistiger Behinderung.
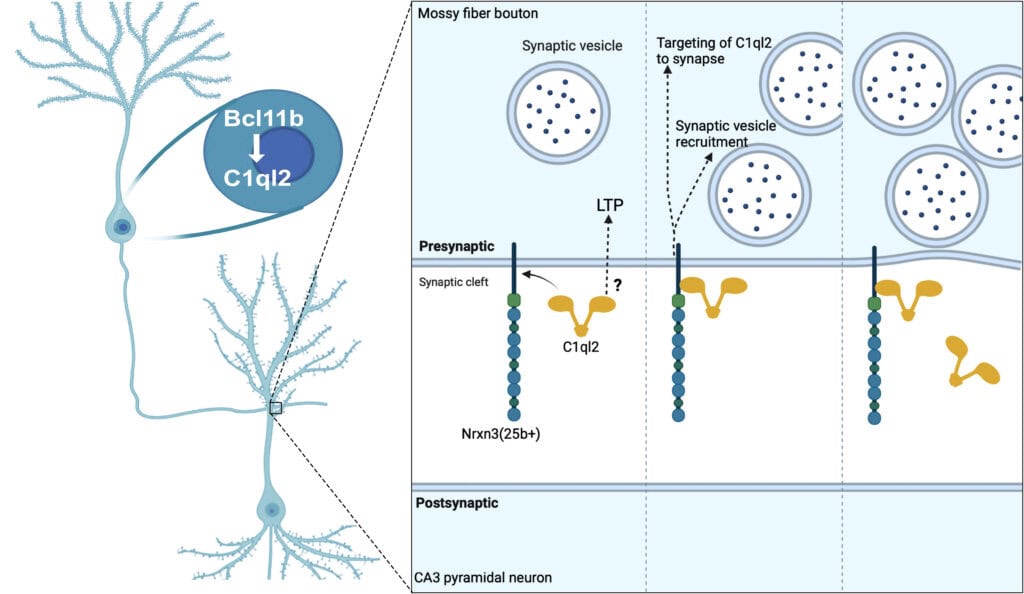
Ein wichtiger Regulator der Aktivität an der Synapse ist ein Protein namens Bcl11b, das mit Erkrankungen in Verbindung gebracht wird, die von synaptischer Dysfunktion betroffen sind. Es spielt eine entscheidende Rolle bei der Aufrechterhaltung spezifischer Verbindungen, der sogenannten Moosfasersynapsen, die für Lernen und Gedächtnis wichtig sind. Eines der von Bcl11b regulierten Gene ist C1ql2, das für ein synaptisches Protein kodiert. Es war bisher unklar, welche molekularen Mechanismen Bcl11b nutzt, um diese Aufgabe zu erfüllen.
Um diese Frage aufzuklären, untersuchte Artemis Koumoundourou aus dem Labor von Stefan Britsch an der Universität Ulm zusammen mit ihren Kollegen aus der Arbeitsgruppe von Bernd Heimrich an der Universität Freiburg, dem Labor von Andreas Draguhn an der Universität Heidelberg und dem Labor von Markus Missler an der Universität Münster die Rolle von C1ql2 in Moosfasersynapsen von erwachsenen Mäusen. Experimente, bei denen die Produktion von C1ql2 unabhängig von Bcl11b manipuliert wurde, zeigten, dass C1ql2 für die Rekrutierung von Vesikeln an der Synapse und die Stärkung der synaptischen Verbindungen zwischen Neuronen unerlässlich ist. Weitere Untersuchungen zeigten, dass die Rolle von C1ql2 in diesem Prozess von der Wechselwirkung mit einem anderen synaptischen Protein namens Neurexin-3 abhängt. Die Unterbrechung dieser Interaktion führte zu einer Verringerung der C1ql2-Menge an der Synapse und folglich zu einer Beeinträchtigung der Vesikelrekrutierung.
Diese Erkenntnisse werden zum Verständnis der Entstehung von neurologischen und neuropsychiatrischen Störungen beitragen. Bcl11b, C1ql2 und Neurexin-3 wurden unabhängig voneinander mit diesen Erkrankungen in Verbindung gebracht, und die jetzt entdeckten Wechselwirkungen zwischen diesen Proteinen bieten neue Einblicke in die molekularen Grundlagen synaptischer Störungen. Diese Forschungsarbeit eröffnet neue Perspektiven zu weiteren Untersuchungen darüber, wie diese Proteine interagieren und welche Rolle sie bei Gesundheit und Krankheit des Gehirns spielen.